使用帮助
主要用于使用SHELXL精制大分子的问题
1、为SHELXL 创建.hkl输入文件的最佳方法是什么?
答:许多商业系统(例如Bruker APEX2 / PROTEUM2)可以直接创建此文件。如果您使用SHELXC / D / E或hkl2map来解决结构,则会将此文件作为副产品获取。如果你只有.mtz文件,请务必保持强度并在CCP4中设置free-R标志。然后你可以使用TimGrüne的mtz2hkl制作.hkl文件。如果.mtz文件中没有强度 ,mtz2hkl可以生成包含F值而不是强度的.hkl文件,但是在读取文件时必须小心指定。另见Q21。
2、如何为SHELXL 设置第一个.ins文件?
答:您必须使用SHELXPRO(SHELX-97的一部分)中的“I”选项,直到更好的程序准备就绪。然后,您需要自己添加除20种标准氨基酸以外的残留物的限制。
3、我在哪里可以找到合适的几何约束?
答:一个好的开始是CCP4单体库。更好的是,Dale Tronrud设置了一个 cdl_shelxl Web服务器,可以读取PDB文件并输出改进的构造依赖DFIX, 党 和 CHIV限制SHELXL蛋白质的改良。有关详细信息,请参阅Tronrud和Karplus, Acta Cryst。 D67(2011)699-706。对于小分子, PRODRG Web服务器 可以生成SHELXL格式的几何约束。Global Phasing GRADE Web服务器可能提供最准确的约束,也可以直接以SHELXL格式创建它们(DFIX, 党 和 平面)。这些约束可以插入 .ins文件或写入单独的文件,并使用SHELXL .ins文件中的'+ filename'或'++ filename'选项读入。
4、如何在SHELXL细化后观察电子密度?
答:运行SHELXL细化列表6,然后较新版本的Coot将能够读取生成的.res和.fcf文件并显示地图。不幸的是,如果您使用Coot编辑模型并尝试将其写入.ins文件以进行下一个SHELXL细化作业,则几乎肯定需要进行一些手动编辑。TimGrüne的shelx2map可用于将.fcf文件转换为PYMOL可以读取的CCP4格式映射(以及来自SHELXL 的.pdb文件)。这是获得包含电子密度的出版物质量图的推荐方法。
5、我如何计算标准偏差?
答: 这需要全矩阵细化。通常只需要坐标中的esds和派生的几何参数。精炼后与之融合CGLS,单周期的全矩阵细化(LS 1)仅针对坐标执行(BLOC 1),删除所有几何约束和零移位乘数(DAMP 0 0)。可能需要微调内存分配-一个 和 -b运行时标志。对于非常大的结构,可能需要使用由定义的重叠块进行几个细化周期集团说明。为了获得各种几何参数的esds,考虑完整的相关矩阵, RTAB, MPLA, 键 和 HTAB可能用过了。.lst文件中原子名称下面出现的数字是Ångstroms中的径向原子位置esd。
6、如何在对称元素上生成约束?
答:您需要指定一个EQIV 指令,然后参考对称生成的原子使用 _ $ 1 例如,如果Cys29的SG与其对称等效物的二硫键被(0.5,y,0.5)的晶体双轴一分为二,则需要指定:
EQIV $ 1 1-x,y,1-z DFIX_29 2.031 SG SG_ $ 1 DANG_29 3.035 CB SG_ $ 1 SG CB_ $ 1
7、我什么时候应该加氢?
答: 使用添加氢HFIX 要么 AFIX改进了模型,不添加任何额外的参数。最好在添加氢之前对模型进行模拟,因为程序将正确添加无序氢(!)。然而,不建议在-OH基团(Tyr,Ser和Thr)中加入氢, 因为(a)它们对R值几乎没有影响,(b)程序难以准确预测其位置, (c)如果程序意外地将两个氢分配到相同的H键,然后使用骑行模型进行精炼 (AFIX 83)打开防撞击限制(BUMP),氢之间的排斥可能会在结构中引入机械变形。应将氢单独添加到组氨酸的环N原子中,考虑可能的H-键和金属配位(或省略)。向蛋白质中的C和N原子添加氢通常会使R1和R1(游离)减少相同的量,通常为0.5至1%。使用精确的小分子数据,下降可以大得多。
8、当我添加氢时,程序说:
** BAD AFIX CONNECTIVITY:CB_21 BONDS TO CA_21 **。我该怎么办?
答:该计划无法将氢添加到CB_21,因为侧链的其余部分缺失。当侧链的其余部分没有密度时,这是推荐的过程,但是有必要添加一条指令:HFIX 0 CB_21 在冒犯之前 HFIX指示关闭仅为此特定残留物添加CB氢。类似的错误消息也可能由不良几何导致连接数组中的错误导致,这些可以通过更正自由 和/或 BIND 说明。
9、加入氢后,SHELXL抱怨:
** BAD AFIX连接:N_1 BONDS到CA_1 **。怎么了 ?
答:该计划正试图将终端N变成酰胺而不是-NH3+,它不起作用,因为它只与一个原子键合。包括HFIX 33 N_1 在另一个之前 HFIX说明。该程序始终适用于第一个 HFIX 这适合于给定的原子。
10、C末端是否需要特殊限制?
答:是的。通常C-末端是羧酸盐(-CO2-)具有相等的CO键长度,如Glu或Asp侧链的末端。然后最好将这些原子命名为OT1和OT2(以便不应用通常的限制)并添加适当的额外限制,例如
DFIX_129 1.249 C OT1 C OT2 DANG_129 2.194 OT1 OT2 DANG_129 2.379 CA OT1 CA OT2
11、模拟无序侧链的最佳方法是什么?
答:用Coot看地图,看看哪个是第一个无序原子(比如CG)。然后返回一个原子(到CB)并放一个 第1部分10.66 在它和之前 第0部分在侧链的最后一个原子之后。运行另一个改进工作并再次查看密度,第二个构造现在应该更加清晰,并且应该可以将它与Coot拟合。您可能必须移除一个或两个试图模仿第二个构造的水。添加 0.66 到最后 FVAR 为第一个组件的占用引入一个新的自由变量的指令(比如fv(5)),改变 部分 第一个组件之前的指令 第1部51 并插入一条指令 第2 -51部分在第二个组件之前(也应该从CB开始)。然后,第二组分中的原子都具有1-fv(5)的占有率。fv(5)将从0.66的起始值进行细化,这可能是一个很好的第一近似值。在以正常方式添加氢之前,最好这样做HFIX这样就会自动考虑到这种疾病。通常,原子在不同部分 应该具有相同的名称,并且约束将适用于两种构造 部分考虑到了。如果两种(或更多种)组分在化学上不同,则应给它们不同的名称。然后可以使用这些名称为仅一个组件添加适当的约束。
12、我有一种环状蛋白,其中N_1与C_99形成正常的肽键。我如何说服该程序将肽限制应用于这些残留物?
答:只需改变 RESI 残留物1的说明(比如说 RESI遇到1) 至 RESI遇到1 100。第二个残留数是别名。该_ + 和 _-连接相邻残基中原子的束缚使用的算子适用于残基数及其别名(如果有的话)。相同的技术可用于桥接序列中的缺失; 插入是可能的,但更棘手(不仅仅是SHELXL!)。
13、Rfree在各向异性上仅下降0.2%,但地图要好得多。当然我应该继续各向异性细化?
答:不!回到各向同性。Rfree下降0.2%通常不显着,因为Rfree使用相对较少的反射。保持R和Rfree之间的差距尽可能小也很重要。你的地图看起来“更好”,因为它们看起来更像你的模型 - 这就是过度拟合(或模型偏见)的全部意义!
14、是否有可能读取部分结构因素,例如,对于比SHELXL提供的原始Babinet模型更复杂的溶剂模型?
答:是的。使用ABIN读取包含h,k,l 的.fab文件以及计算出的结构因子的实部和虚部,以获得更好的溶剂模型(您可能需要编写一个小程序来生成此文件)。ABIN允许为这些贡献细化单独的比例和B因子。这甚至适用于孪生结构(.fab文件应仅针对一个组件计算)。
15、如何生成欧米茄角的直方图?
答:一个实用的解决方案是在最后一个.lst文件中取出“二面角OMEG”后面的表格,将其 粘贴到另一个文件中,然后使用gnuplot或某些Office软件制作直方图。不是很优雅,但它的工作原理。
16、Molprobity和PDB不喜欢SHELXL的氢原子名称,并抱怨-CH的“手性”2- 团体!
答:没有氢的 沉积结构 (WPDB 2)!如果您需要将氢用于其他目的,可以使用MolProbity以常规名称再生它们。SHELXL不喜欢以数字开头的原子名称,因此不能使用这些原子名称。
17、Coot可以正常使用SHELXL-97 的.fcf文件,但无法读取新SHELXL中的文件!?
答: IUCr CIF委员会弃用了'_symmetry_equiv_pos_as_xyz'并将其替换为'_space_group_symop_operation_xyz',因此必须在.cif和.fcf文件中使用新名称。许多读取这些文件的程序(包括Coot,CIFTAB / XCIF,PLATON,CheckCIF等)都被作者迅速修改,以了解这两个名称。当然,较旧版本的Coot等不了解新名称。请下载最新版本的Coot,这个问题就会消失。这只是CIF定义不必要的变化导致的巨大混乱和浪费时间的一个例子!
 化学晶体软件 Shelxtl v6.1/6.2 破解版
化学晶体软件 Shelxtl v6.1/6.2 破解版
 化学晶体软件 Shelxtl v6.1/6.2 破解版
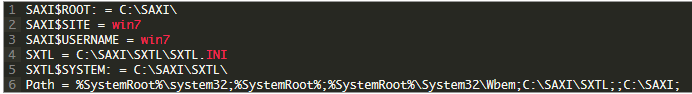
化学晶体软件 Shelxtl v6.1/6.2 破解版